3月15日凌晨,生物医药公司Madrigal Pharmaceuticals研发的药物Resmetirom获FDA批准,用于治疗代谢功能障碍相关脂肪性肝炎(MASH,曾称为NASH)成人患者,这是全球首款获批上市的MASH药物。
Resmetirom是一种靶向肝脏的甲状腺激素受体 β(THR-β)口服选择性激动剂。在MASH中,肝脏中的甲状腺激素β活性受损,导致线粒体功能降低和脂肪酸的β氧化,进而导致炎症和肝纤维化,Resmetirom旨在靶向这一基础病因。
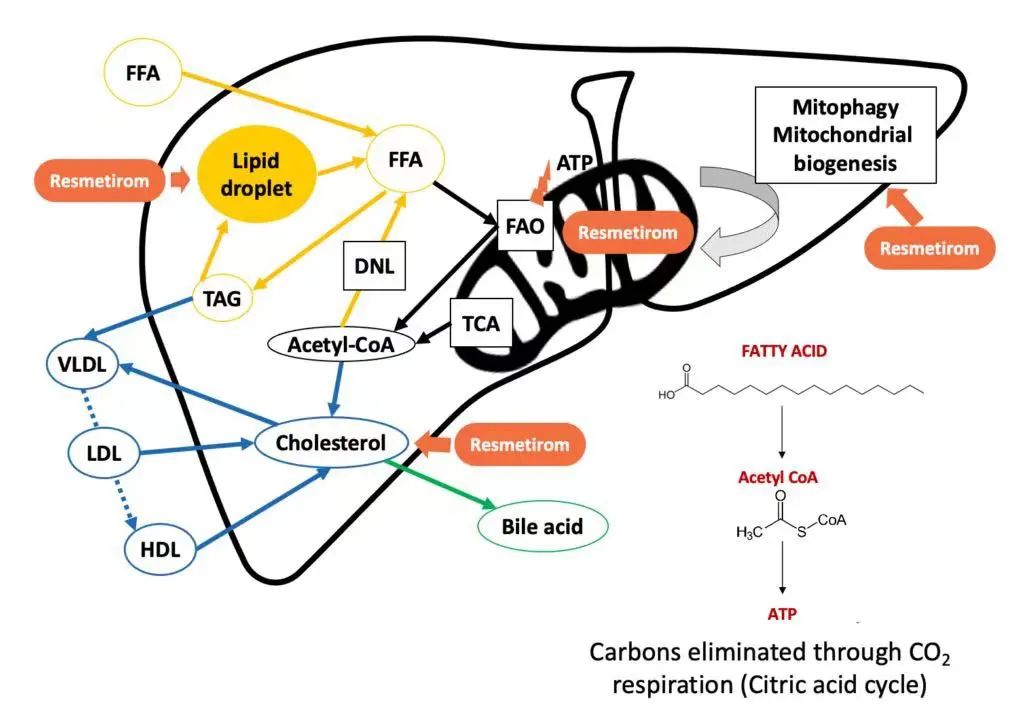
Resmetirom 药物的作用机制,来源:公司官网
2023年12月,Madrigal曾宣布Resmetirom治疗MASH的III期MAESTRO研究达到了双重主要终点。III期临床试验数据显示,相较于安慰剂组,服用两种剂量的Resmetirom药物的患者均达到两项终点:患者拥有更高的症状缓解水平和肝脏纤维化改善水平,达到非酒精性脂肪性肝病活动评分(NAS)下降的主要终点,同时也实现了低密度脂蛋白胆固醇水平(LDL)下降,达到关键次要终点。

临床 Ⅲ 期试验疗效分析,来源:公司官网
除此之外,基于MAESTRO-NAFLD-1临床试验的研究数据显示,Resmetirom安全性且耐受性良好,并且在肝脏和心血管健康的关键指标方面拥有统计学上显著的改善。
----MASH药物的蓝海市场----
MASH是代谢功能障碍相关脂肪性肝病(MAFLD)的严重类型,被定义为5%以上的肝脏脂肪变性,合并炎症、肝细胞损伤,伴有或者不伴有纤维化。
MASH的发生可能是由环境、遗传、饮食和代谢等因素相互作用的结果,其组织病理学改变包括脂肪酸堆积、线粒体功能障碍、自由基的产生、氧应激、脂质过氧化和内毒素介导的细胞因子释放等。
在全球范围,目前已经有超1亿例MASH患者,仅在美国就有2200万人患有MASH,其中800万人患有伴有严重肝纤维化的MASH。
由于MASH阶段慢性炎症和肝纤维化将造成患者肝脏不可逆受损,被认为是进展成肝硬化、肝衰竭或肝细胞癌等终末期肝病的关键阶段。
由于发病机制复杂,MASH自1980年被发现以来,此前全球尚未有MASH治疗药物获得美国FDA、欧洲EMA的批准,吉利德、诺华、辉瑞、Intercept、Genfit等大小药企纷纷折戟于此。
MASH市场需求却极其庞大,根据弗若斯特沙利文,2020年全球MASH药物市场规模已经达19亿美元,到2030年将达到322亿美元,复合年增长率24.6%。中国MASH药物市场2020年达7亿元人民币,到2030年预计达到355亿元人民币,复合年增长率61.4%。
正是为了鼓励MASH新药的开发,全球肝脏协会在2023年宣布将其由非酒精性脂肪性肝炎(NASH,Nonalcoholic Steatohepatitis)更改为代谢功能障碍相关脂肪性肝炎(MASH,Metabolic dysfunction-associated steatohepatitis),呼吁人们认识到精确疗法和以患者为中心的护理在治疗MASH中的重要性。
如今,随着Resmetirom成为第一款获得FDA批准的MASH药物,这场持续了40多年的困局,终于迎来了胜利的曙光。
当然,除了Madrigal,国内外也不乏药企瞄准了MASH这一市场。据不完全统计,全球有超500个MASH新药项目在研,其中有超过200个项目处于临床开发阶段。
关于MASH领域的更详细了解,可参见倚锋资本此前的行研:《NASH的成因与治疗|倚锋硬分享》