2024开年,狂热的“买买买”浪潮扑面而来,BD和并购大年以目不暇接的方式揭开帷幕。
新年刚过十多天,超过20起授权及并购转让正在发生,摊到每天至少有1起交易,涉及到的中国企业包括宜联生物、安锐生物、信瑞诺医药、箕星药业、舶望制药等,跨国MNC包括罗氏、阿斯利康、勃林格殷格翰、拜耳等。
稍远一些的2023年,BD交易更是从年头火到了年尾。根据动脉网不完全统计,2023年中国药企BD交易事件共124件,BD总额再创新高,达505.9亿美元,同比增长41%,License out成为2023年BD交易关键词。
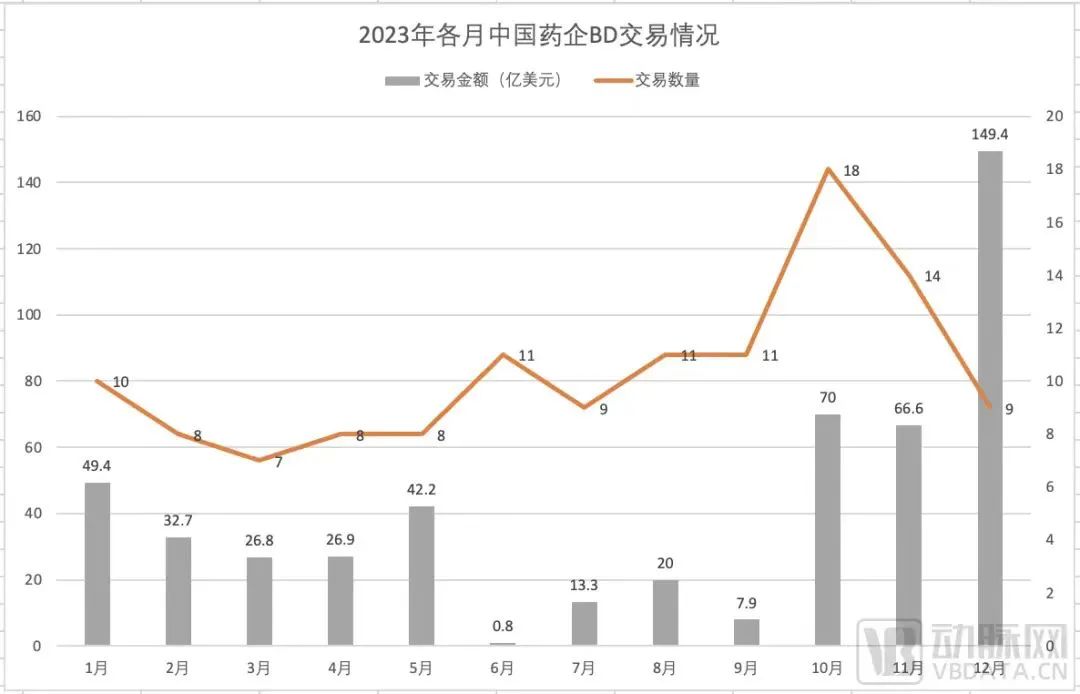
2023年各月中国药企BD交易情况,来源:见水印
回溯中国本土企业的license out历史,微芯生物开创了中国创新药对外进行专利授权的先河,其研发的西达本胺早在2006年就与HUYA达成合作授权,成为中国首个授权美国等发达国家使用专利、并实现全球同步开发的原创新药。
而倚锋资本押注的第一个原创药项目,便是微芯生物。继往开来,伴随国产创新药从莽荒年代迈向航海时代,专注生物医药投资的倚锋资本,也开始站在创新药BD的聚光灯下。
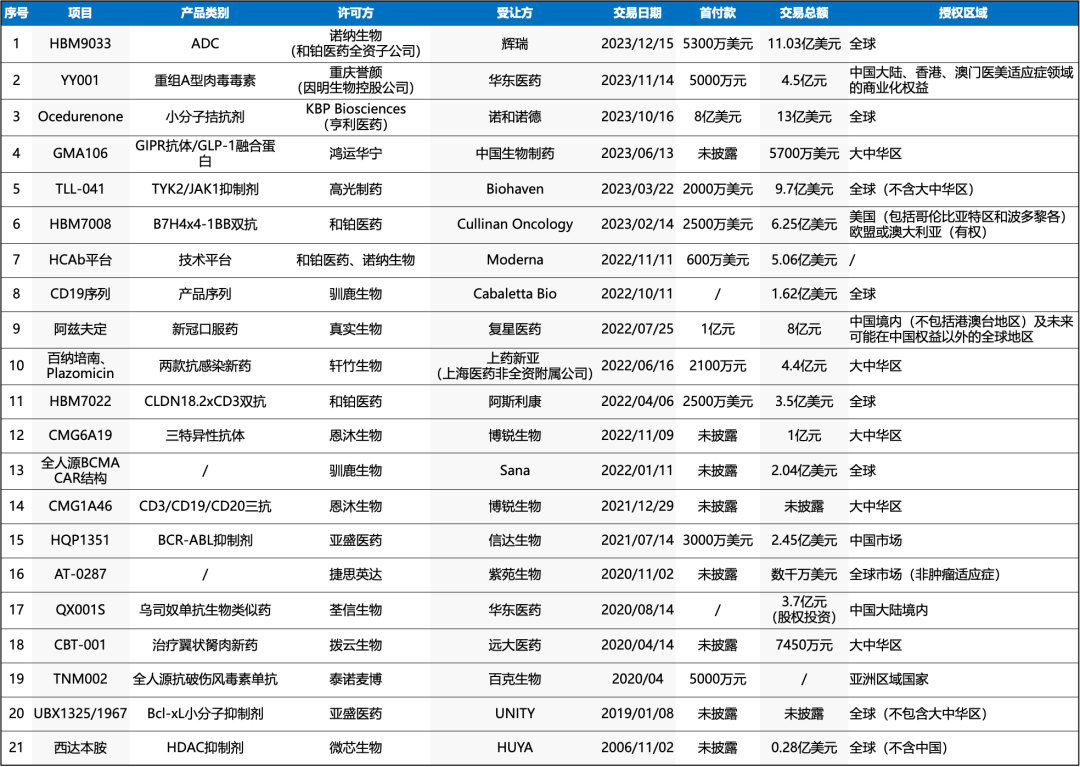
以下是我们对被投企业BD交易的统计:21笔BD交易累计潜在总金额将近60亿美元(根据已披露金额不完全统计,兑换汇率按2024年1月17日计算),同时可以看到,BD案例数量、金额逐年快速上升,尤其是license out出海的案例增多,其中2023年就有3个10亿美金级的deal。
而且,仔细分析以上所有交易还会发现,BD交易涉及的技术种类正逐年丰富,ADC、双抗、大分子、小分子药物不一而足,授权的标的也不再局限于产品,一些产品序列、结构、技术平台也获得了海外药企的青睐。
以下是对21笔BD的详细盘点:
1.和铂医药HBM9033:潜在“best-in-class”ADC
2023年12月15日,和铂医药及其全资子公司诺纳生物共同宣布,与辉瑞就靶向人间皮素(MSLN)抗体偶联药物(ADC)HBM9033的全球临床开发和商业化签订独家授权协议。

根据协议条款,诺纳生物将获得5300万美元预付款和近期付款,及最高达10.5 亿美元里程碑付款;此外,诺纳生物还有资格从净销售额中获得从高个位数到高十位数不等的分级特许权使用费。
HBM9033曾由和铂医药与宜联生物合作开发,采用宜联生物最新一代ADC技术平台TMALIN®,可实现高DAR值均一性稳定偶联的同时,进一步提高ADC药物的治疗窗;全人源单克隆抗体由Harbour Mice®平台产生,与可溶性MSLN相比,其能更好地与膜结合型MSLN结合并最大限度减少游离型MSLN的干扰。
HBM9033特异性靶向MSLN该肿瘤相关抗原在包括间皮瘤、卵巢癌、肺癌、乳腺癌和胰腺癌等多种实体瘤中上调。该ADC利用肿瘤特异性可切割链接物和新型拓扑异构酶抑制剂来提高稳定性和活性,其独特的抗体和连接符载荷设计已在临床前研究中展现出卓越的疗效和安全性。
此前2023年8月,HBM9033已获美国FDA的新药研究申请许可,在美国启动临床试验,该项I期研究旨在评估HBM9033在晚期实体瘤患者中的安全性、耐受性、药代动力学和抗肿瘤活性。
2.因明生物YY001:全球首个及唯一临床阶段的重组A型肉毒毒素产品
2023年11月14日,华东医药发布公告称:其全资子公司欣可丽美学、杭州产投、拱墅国投,与因明生物控股的重庆誉颜签署股权投资协议,各投资方3亿元认购重庆誉颜注册资本210万元,对应交易后8.5714%股权。其中欣可丽美学出资1.5亿元,交易后持有4.2857%的股权。

同时,华东医药还与重庆誉颜签署独家经销协议,获得重庆誉颜拥有的重组A型肉毒毒素YY001在中国大陆、香港、澳门医美适应症领域的独家商业化权益。为此,华东医药将向重庆誉颜支付5000万元首付款,以及最高不超过1亿元的注册里程碑付款。
本次合作所涉及的产品YY001,这是重庆誉颜研发的全球首个及唯一临床阶段的重组A型肉毒毒素产品。YY001是由一种通过新型的重组蛋白生产途径生产的肉毒毒素,旨在解决从宿主肉毒杆菌提取天然肉毒毒素的生物安全问题。
作为一种高度差异化的产品,YY001具有高纯度、良好的安全性及生产可扩展性等多种优点,其高纯度降低了将外源蛋白引入人体有关的免疫原性风险,并可提高YY001给药的整体安全性。
3.亨利医药Ocedurenone:新一代口服小分子MRA
2023年10月16日,诺和诺德宣布引进KBP Biosciences(亨利医药)的肾病高血压药物Ocedurenone(产品代号为KBP-5074),合作总金额高达13亿美元。

Ocedurenone是一款由亨利医药自主研发的新一代、口服小分子非甾体类选择性盐皮质激素受体拮抗剂(MRA),目前正处于中晚期慢性肾脏病合并为控制高血压的III期临床阶段。
Ocedurenone已进行了包括II b期临床试验(BLOCK-CKD)在内的9项临床试验研究。BLOCK-CKD Ⅱb期临床研究结果显示,患者用药84天后,经安慰剂组校正,Ocedurenone 0.25 mg和0.5 mg剂量组患者的收缩压分别降低7.0 (3.37) mmHg (P=0.0399)和10.2 (3.32) mmHg (P=0.0026),表明Ocedurenone能够为患者带来具有显著临床意义的降压疗效,且Ocedurenone在该两种剂量组均未出现严重高钾血症和急性肾损伤。
当前,Ocedurenone对中晚期慢性肾脏病合并未控制高血压患者开展的CLARION-CKD的 III期国际多中心临床研究已在美国、欧洲和亚洲启动,预期将在全球150多个临床中心同步开展,入组超过600名患者。
4.鸿运华宁GMA106:双靶点减重创新药
2023年6月13日,中国生物制药与鸿运华宁达成合作协议,共同开发双靶点减重创新药GMA106,鸿运华宁将从交易中获得最高5700万美元的首付款与里程碑付款等,而中国生物制药则将得到GMA106在大中华区的独家开发和商业化权益。

GMA106是一种GIPR(胃抑制多肽受体)拮抗/GLP-1R(胰高血糖素样肽-1受体)激活剂,利用特有的M-Body技术可使其在特异性阻断GIPR信号通路的同时激活GLP-1R,降低体内脂肪蓄积,减缓胃排空,抑制食欲,通过多通路协同达到比单GLP-1受体激动剂更好的减肥效果,降低单位体重脂肪含量的同时,不降低肌肉含量。此外,靶点GIPR的价值还集中于助推GLP1激动剂在糖尿病领域的更新换代,同时避免了GLP1类药物治疗带来的恶心和呕吐的副作用。
在澳洲进行的I期临床试验,显示出GMA106良好的耐受性与安全性,不仅未存在明显副作用,而且其分子内的抗体半衰期长(约53天),目前未揭盲的药效数据表明,停止给药后(3-5个月),明显防止减重后反弹。这些特性都使得GMA106有望成为新一代减重、减脂、停药防反弹的候选减肥药物。此外,GMA106还具备拓展用于治疗非酒精性脂肪肝炎(NASH)的巨大潜力。
5.高光制药TLL-041:全球首个具有通过血脑屏障能力的高选择性双靶点TYK2/JAK1抑制剂
2023年3月22日,Biohaven Ltd (NYSE: BHVN)宣布与杭州高光制药有限公司(“高光制药”)达成在大中华区域以外的独家开发与许可协议,引进后者研发的TLL-041。根据协议,Biohaven将支付2000万美元首付款(现金+股票)、9.5亿美元里程碑款及多层次、比例不等的销售分成。

TLL-041是全球首个具有通过血脑屏障能力的高选择性双靶点TYK2/JAK1抑制剂。TYK2和JAK1是处理一系列促炎症细胞因子的STAT通路调节剂;抑制这些激酶可能在减少神经系统疾病的炎症方面发挥重要作用,包括帕金森病、阿尔茨海默病、肌萎缩性侧索硬化症和多发性硬化症。
TLL-041已经证明了对JAK2、JAK3和其他激酶的高选择性,与选择性较低或无选择性的JAK抑制剂相比,有可能提供更好的安全性。TLL-041的作用机理在多个临床前模型中得到证明。
6.和铂医药HBM7008:全球首个B7H4x4-1BB双抗
2023年2月14日,和铂医药宣布与Cullinan Oncology, Inc.(纳斯达克:CGEM)签订授权及合作协议,授予Cullinan Oncology在美国(包括哥伦比亚特区和波多黎各)开发及商业化HBM7008的独家许可权。
根据协议,和铂医药将获得2500万美元预付款和最高达6亿美元里程碑付款,以及最高近20%销售额百分比的分级特许使用权费。Cullinan Oncology将承担在美国地区开发及商业化HBM7008的所有费用,和铂医药保留美国地区以外HBM7008的所有权利。
此外,Cullinan Oncology亦有权在欧盟或澳大利亚进行人体临床研究(前提为和铂医药将保留HBM7008的所有权利)并与和铂医药共享相关临床资料。
HBM7008是一种针对肿瘤相关抗原B7H4x4-1BB的双特异性抗体,由于其高度依赖以肿瘤相关抗原为介导,与T细胞活化进行交叉链接,因此在T细胞共刺激及抑制肿瘤生长方面的功效显著,同时提高安全性。
HBM7008基于和铂医药创新的HBICE®平台开发的全人源双特异性抗体,也是目前全球针对这两个靶点的唯一双特异性抗体。其独特的肿瘤表达特异性和免疫调控活性,有望在PD-L1阴性或对PD-1/PD-L1免疫治疗药物具耐药性的患者中,产生更好的疗效。凭借其新型生物学作用机制及双抗设计,有望避免4-1BB可能引发的肝毒性风险。
7.和铂医药HCAb平台:全球唯二的全人源重链抗体平台之一
2022年11月11日,和铂医药宣布,全资子公司诺纳生物与Moderna已订立授权及合作协议。战略合作将专注于使用公司专有的仅重链抗体(「HCAb」)发现平台发现及开发基于核酸的免疫疗法。

协议签订后及在其条款及条件的规限下,Moderna将获授独家可再授权许可,以利用公司HCAb平台衍生的一组针对多个靶点的序列开发核酸产品。Moderna将对协议项下所有即将开展的开发、生产、监管及商业化活动承担全部责任。
根据协议,诺纳生物收取600万美元的一次性、不可退还的预付款及根据若干监管、开发及销售里程碑的实现情况收取潜在里程碑付款最多约5亿美元。同时,诺纳生物将有资格向Moderna收取协议项下所开发的每种产品的分级特许使用权费。
此外,莫德纳还将有权选择获得额外靶点序列的独家可再授权许可,诺纳生物将获得相应的预付款、里程碑付款以及分级特许权使用费。
和铂医药的HCAb专利技术能够开发新一代的全人源重链抗体,该抗体的大小只有传统IgG抗体的一半,几乎解决了轻链错配和异源二聚化的问题,具有和IgG抗体类似的药代动力学特性和Fc介导的效应功能,但不需要人源化或其他抗体工程改造。此外,该平台还可以开发多种新型治疗性抗体形态,包括单域抗体、双特异性和多特异性抗体、抗体药物偶联物、CAR-T或其他VH单域衍生产品。
8.驯鹿生物CD19序列
2022年10月11日,驯鹿生物宣布,授予 Cabaletta其经临床验证的全人源CD19序列的全球独家开发、生产及商业化权利,应用于Cabaletta在自身免疫性疾病领域开发修饰T细胞的产品中。

驯鹿生物将有资格获得最多两款产品, 累计约为1.62亿美元的首付款以及潜在开发和商业化里程碑付款和销售分成。驯鹿生物拥有在大中华区使用该许可序列开发Cabaletta产品并将其商品化的优先权。
CD19靶向嵌合抗原受体(CAR)T细胞疗法在临床上已经被证明能深度并持久的清除B细胞,从而在B细胞恶性肿瘤的治疗中表现出显著疗效,这一变革性疗法为B细胞介导自身免疫性疾病患者的治疗前景提供了有力支持。
9.真实生物阿兹夫定:首款国产新冠口服药
2022年7月25日晚间,复星医药发布公告,公司控股子公司复星医药产业与真实生物签订《战略合作协议》,就推进双方联合开发并由复星医药产业独家商业化阿兹夫定等事宜达成战略合作。
本次合作领域包括新冠病毒、艾滋病治疗及预防领域;拟合作区域为区域 1(即中国境内,不包括港澳台地区)以及区域2(即区域1以外的全球地区,但不包括俄罗斯、乌克兰、巴西及其他南美洲国家和地区)。

从具体合作形式来看,复星医药将直接支付1亿元首付款,此后针对国内权益首付3.995亿元,海外(但不包括俄罗斯、乌克兰、巴西及其他南美洲国家和地区)权益首付3亿元。后续国内将根据销售渠道按照复星真实50%:50%或55%:45%进行权益分成,销售费用由复星承担。
阿兹夫定是中国自主研发的口服小分子新冠病毒肺炎治疗药物。2021年7月20日,国家药监局已附条件批准其与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。2022年7月25日又附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎(COVID-19)成年患者。
10.轩竹生物百纳培南、Plazomicin:两款抗感染新药
2022年6月16日,轩竹生物与上海医药非全资附属公司上药新亚订立许可合约,以在大中华区就轩竹生物的两款抗感染新药产品百纳培南及Plazomicin原料药和制剂与上药新亚达成独家授权许可。

根据授权许可合约的条款,上药新亚将获得上述两款产品原料药和制剂在大中华区的独家权益,包括分许可、研发、生产、商业化等在内的一切权益,并成为两款产品在大中华区的上市许可持有人(MAH)。轩竹生物将获得2100万元的预付款,并有权收取最高不超过4.19亿元的里程碑付款,以及最高可达两位数的分级特许销售分成。
资料显示,百纳培南原料药及注射用百纳培南制剂是轩竹生物自主研发的1.1类新型碳青霉烯类抗生素新药,拟用于治疗复杂性尿路感染和社区获得性肺炎。复杂性尿路感染适应症已在国内完成II期临床试验,即将启动III期临床研究。
Plazomicin原料药及Plazomicin注射液是由美国Achaogen公司开发的新一代半合成氨基糖苷类抗生素,主要通过与细菌核糖体30S亚基结合,产生抑菌作用,开发用于治疗多药耐药(MDR)革兰氏阴性菌肠杆菌科细菌导致的严重感染。2019年12月轩竹生物已收购该产品在大中华地区的一切所有权益及相关知识产权。
11.和铂医药HBM7022:中国首个成功出海的双抗
2022年4月7日,和铂医药宣布,与阿斯利康就CLDN18.2xCD3双特异性抗体(HBM7022)的开发与商业化达成全球对外授权协议。

根据协议,阿斯利康将获得HBM7022的研究、开发、注册、生产和商业化的全球独家许可,并负责HBM7022临床前的进一步开发及商业化相关的所有费用。和铂医药将获得2500万美元的预付款和最高达3.25亿美元的里程碑付款,以及基于未来HBM7022销售额的特许权使用费。
HBM7022 为靶向肿瘤相关抗原Claudin18.2 (CLDN 18.2) 和CD3的双特异性抗体,通过结合肿瘤细胞及T细胞,强烈活化T细胞并杀伤肿瘤细胞。HBM7022采用二价高亲和力抗CLDN18.2和单价低亲和力抗CD3的结构,在保证高杀伤活性的同时,降低了产生细胞因子风暴的风险。
临床前研究表明,该抗体不但对CLDN18.2阳性的胃癌有显著效用,还对胰腺癌和CLDN18.2突变的胃癌有很好的效用。HBM7022 是由公司 HBICE®平台开发的全人源双特异性抗体,得益于独特的平台技术,HBM7022展现出良好的安全性、药代动力学特征和可开发性。凭借其独特的分子设计和出色的临床前资料,HBM7022有望在未来的临床研究中引领新一代实体肿瘤的T细胞衔接器疗法。
12.恩沐生物CMG6A19:针对实体肿瘤的T细胞介导三特异抗体
2022年11月8日,恩沐生物与博锐生物达成协议,授权博锐生物进行恩沐生物的三特异抗体CMG6A19的临床前开发和在大中华地区的临床注册、开发、生产以及商业化。

恩沐生物将保留CMG6A19在大中华地区以外的所有权利,负责全球其他地区的临床注册、开发、生产和商业化。恩沐生物将获得来自博锐生物的累积超过1亿人民币的含首付款和研发及销售里程碑付款,以及基于大中华区内CMG6A19的销售分成。
CMG6A19是一个针对实体肿瘤的T细胞介导三特异抗体,基于恩沐生物的多功能抗体工程平台TRIAD构建,可同时靶向T细胞表面受体CD3和肿瘤相关抗原(TAA)的不同表位,具有更好的肿瘤特异性,同时可以更好的针对TAA突变引起的肿瘤逃逸。
值得一提的是,CMG6A19的设计巧妙的利用了TRIAD灵活性高的平台优势,在开发过程中通过调节靶向片段的空间位置,结合TAA自身的结构特征,双表位靶向使产品能选择性的针对TAA高表达肿瘤并表现出明显优于MNC在研同类产品的显著的杀伤作用,而对TAA正常水平表达组织作用大幅减弱,进而具有比这些同类产品更好的安全性。
13.驯鹿生物全人源BCMA CAR结构
2022年1月11日,驯鹿医疗与信达生物授予Sana其经临床验证的全人源BCMA CAR结构的非独家商业权利,应用于Sana特定的体内基因治疗和体外低免疫细胞治疗产品开发。

驯鹿医疗和信达生物将获得Sana支付一笔首付款以及有资格获得最多6个产品、约为2.04亿美元的潜在开发、注册里程碑付款和销售分成。
在针对复发/难治性多发性骨髓瘤的治疗中,B细胞成熟抗原(BCMA)已被证实可作为自体CAR T疗法的特异性靶点。此次授予Sana的BCMA CAR是驯鹿医疗与信达生物合作开发的一项靶向BCMA的自体CAR T细胞治疗产品(CT103A)中的关键成分,该产品在中国获得了良好的临床安全性和有效性数据。
14.恩沐生物CMG1A46:全球首个获批临床的CD3/CD19/CD20三抗产品
2021年12月29日,博锐生物与恩沐生物达成独家合作和授权,引进CMG1A46在大中华区(包括中国大陆、香港、澳门及台湾)的独家临床开发、生产及商业化权益。

公开信息显示,BR110是以CD3、CD19和CD20为靶点的同类首创T细胞Engager三特异性抗体,它能够同时靶向T细胞表面的CD3以及肿瘤细胞上的两个不同的生物标记物CD20和CD19,通过拉近肿瘤细胞和T细胞的空间距离,激活T细胞,杀伤表达CD19和/或CD20的肿瘤细胞。
2021年底,CMG1A46的临床试验申请获国家药品监督管理局批准,是全球首个获批临床的CD3/CD19/CD20三抗产品。
15.亚盛医药HQP1351:第三代BCR-ABL抑制剂
2021年7月14日晚间,信达生物与亚盛医药开展多层面战略合作,以联合商业化第三代BCR-ABL抑制剂HQP1351,并对CD20抗体达伯华(利妥昔单抗注射液)及CD47抗体IB188(letaplimab)和Bcl-2抑制剂APG-2575合作临床开发。此外,鉴于亚盛医药的前景具有增长潜力,信达生物将向亚盛医药认购新股份及认股权证。

其中,签署HQP1351合作及授权协议后,信达苏州将向亚盛实体支付3000万美元的首付款。取决于HQP1351达到若干开发注册里程碑,及获批在有关地区内销售时达到若干年度销售表现里程碑,亚盛医药将有资格获得累计不超过1.15亿美元的里程碑付款。
此外,信达生物将按照每股44.0港币认购亚盛医药价值5000万美元的普通股,并获股权认购权证,有权以每股57.2港币的价格认购亚盛医药价值5000万美元的普通股。
HQP1351是亚盛医药开发的一种第三代BCR-ABL抑制剂,它对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果,可用于治疗一代、二代TKI耐药的CML患者。
16.捷思英达AT-0287:针对新靶点的创新药物分子
2020年11月2日,紫苑生物与捷思英达签署专利许可协议,从后者引进AT-0287在非肿瘤适应症领域的全球开发权益。

根据双方签署的专利许可协议,紫苑生物将从捷思英达获得AT-0287在非肿瘤适应症领域的全球权益,为此将向捷思英达支付总额数千万美元的首付款和里程金。若AT-0287成功开发上市销售,捷思英达还可获得个位数的销售收入提成。
AT-0287是由捷思英达针对新靶点自主研发设计的创新药物分子,在临床前研究中显示出了治疗银屑病的潜力。
17.荃信生物QX001S:有望成为国内首个获批的乌司奴单抗生物类似药
2020年8月14日,华东医药全资子公司中美华东与荃信生物签订股权投资和产品合作的战略合作协议。

中美华东将通过增资形式出资37000万元对荃信生物进行股权投资,投资完成后占股20.56%,成为荃信生物第二大股东;同时,双方签署产品合作开发和商业化协议,就荃信生物在研的QX001S在中国大陆境内进行合作临床开发和市场销售。
QX001S为Stelara®(中文名:喜达诺®)(乌司奴单抗)的生物类似药,美国强生公司2022年报显示,2022年Stelara®(乌司奴单抗)全球销售额逼近百亿美元(97.23亿美元),属于自身免疫治疗领域的重磅炸弹品种。
2023年8月,QX001S已正式递交生物制品许可申请(BLA),有望成为国内首款上市的乌司奴单抗生物类似药。
18.拨云生物CBT001:潜在的用于治疗翼状胬肉的首创疗法
2020年4月14日,远大医药与拨云生物订立产品授权协议,获得拨云生物开发的全球创新产品CBT-001在中国大陆、香港、澳门及台湾地区的独家生产(含技术转移)及商业化权利,授权范围涵盖CBT-001包括翼状胬肉在内的全部适应症。

根据授权协议的约定,远大医药将根据产品的注册开发进度分阶段向拨云广州支付首付款和里程碑付款不超过人民币7450万元,并根据CBT-001的年度销售金额净额支付若干比例的权利金。
另外,集团也订立了认购拨云开曼股份的认购协议及股东协议(以上统称「投资协议」),据此远大医药将以代价约563万美元认购拨云开曼的股份,并将占拨云开曼的扩大后股本约6.5%,同时取得拨云开曼的一个董事席位。
CBT-001是一种潜在的用于治疗翼状胬肉(pterygium)的首创疗法,翼状胬肉是一种常见的眼表疾病,也是被大家广泛关注的眼部疾病之一。CBT001旨在介入疾病的早期和中期阶段,通过阻止翼状胬肉的进展、眼部红血丝和血管充血来进行治疗。
19.泰诺麦博TNM002:全球首款抗破伤风毒素单抗注射液
2020年4月,公司与长春百克生物签署合作开发协议,双方将针对泰诺麦博多款天然全人源抗破伤风毒素单克隆抗体药物开发与生产进行全面合作,项目里程碑首付款近5000万人民币。

根据协议条款,长春百克将获得两株抗体的亚洲区域国家的产品开发、生产、推广和市场销售权益,而泰诺麦博保留这两株抗体全球范围内除双方约定区域国家以外的相关权益。双方在各自开发区域,将共享此两株抗体的临床前开发数据及临床数据等。
其中,TNM002是泰诺麦博生物利用HitmAb®技术平台开发的全球首款进入临床阶段的重组抗破伤风毒素全人源单克隆抗体,具有极高的中和破伤风毒素的能力。该注射液通过肌肉注射给药,用于破伤风的预防治疗,无需额外皮试。
2023年12月6日,TNM002注射液的新药上市许可申请(NDA)获得中国国家药品监督管理局正式受理。
20.亚盛医药UBX1325:首个进入眼科临床试验的抗衰老药物
2006年,亚盛医药与UNITY达成关于化合物库的合作协议,UNITY获授权可对亚盛医药的Bcl-2系列化合物进行筛选,以用于在抗衰老领域的开发。2019年1月8日,双方已就选定的化合物UBX1325签订了许可协议。

根据该许可协议条款,亚盛医药有权获得以UNITY普通股形式支付的预付款,以及按照UBX1325的临床开发和商业销售进展获得里程碑付款和销售分成。
UBX1325是一种Bcl-xL小分子抑制剂,是首个进入眼科临床试验的抗衰老药物。UBX1967采用靶向抑制衰老细胞生存所依赖的蛋白质功能,有望为抗VEGF疗法提供一种有价值的替代或辅助治疗选择。
据UNITY发布的新闻稿,在治疗晚期糖尿病性黄斑水肿(DME)或湿性年龄相关性黄斑变性(wet-AMD)且抗VEGF治疗无效的患者的I期临床试验中,大多数接受UBX1325单次注射治疗的患者表现出多项关键性临床指标的快速改善。UBX1325在该患者群体中具有良好的耐受性和安全性,未观察到治疗相关不良事件或限制性毒性剂量(DLT)。
21.微芯生物西达本胺:首个license out的中国原创药
2006年,微芯生物与美国HUYA Biosciences 签订了关于西达本胺的专利技术授权许可(国际权利)和国际临床联合开发的正式协议。
这使得西达本胺成为我国首个授权发达国家的原创型医药专利。根据协议,微芯生物由此获得了2800万美元的资金以及未来的销售分成。
西达本胺为苯酰胺类组蛋白去乙酰化酶(Histone Deacetylase,HDAC)亚型选择性抑制剂,主要针对第I类HDAC中的1、2、3亚型和第IIb类的10亚型,具有对肿瘤异常表观遗传功能的调控作用。西达本胺通过抑制相关HDAC亚型以增加染色质组蛋白的乙酰化水平来引发染色质重塑,由此产生针对多条信号传递通路基因表达的改变(即表观遗传改变),进而抑制肿瘤细胞周期、诱导肿瘤细胞凋亡,同时对机体细胞免疫具有整体调节活性,诱导和增强自然杀伤细胞(NK)和抗原特异性细胞毒T细胞(CTL)介导的肿瘤杀伤作用。
西达本胺还通过表观遗传调控机制,具有诱导肿瘤干细胞分化、逆转肿瘤细胞的上皮间充质表型转化(EMT)等功能,进而在恢复耐药肿瘤细胞对药物的敏感性和抑制肿瘤转移、复发等方面发挥潜在作用。
目前,西达本胺已获批多个适应症,同时,单药及联合其他抗肿瘤药物针对其他血液肿瘤、实体瘤及HIV的临床研究正在美国、日本、中国及中国台湾等国家和地区同步开展。
— 小结和展望 —
经过多年的耐心耕耘与沉淀,国内药企的“合纵连横”不断迎来高潮,License out逐步成为医药板块交易的主旋律。
不过,需要补充强调的是,BD交易虽是国内药企发展的破局利器,但绝不是万能神药——不论是授权方,还是被授权方,亦或投资机构,都需要耕耘打磨,大胆假设,小心求证,才能在众多的珍宝中找到真正的钻石。