据港交所11月30日披露,CLOUDBREAK PHARMA INC.(拨康视云)向港交所主板提交上市申请,UBS瑞银集团、建银国际、华泰国际为联席保荐人。

公开资料显示,拨康视云(曾用名:拨云生物)是一家专注于眼科新药研发的临床阶段生物技术公司,致力于开发新型及差异化疗法,以满足全球未满足的临床需要。倚锋资本在2022年投资拨康视云数千万元人民币。
当前,全球眼病患者人数超17亿,药物市场规模达387亿美元,眼病严重影响人类身心健康。然而受限于眼科疾病的新药研发进展缓慢,新药产出数量较少,临床上需求愈加迫切。特别是近年来,随着人口老龄化趋势加快、生活方式的转变、电子产品的普及以及工作强度的增大,眼科疾病患病率不断上升。
弗若斯特沙利文预计,全球眼科药物市场规模于2022年至2027年期间的复合年增长率为8.1%及于2027年至2032年期间为8.5%。
未来十年,全球眼科药品市场规模将超800亿美元,中国眼科药品市场规模也将超百亿美元。随着眼科疾病的爆发,国际和国内的眼科市场都越来越被重视,眼科新药行业增长空间明确,成为投资新热点。
拨康视云瞄准的正是这样一个巨大且未得到充分服务的市场,建立了强大的研发能力及药物开发模式。
目前,公司已经建立一个由七种候选药物组成的广泛而创新的管线,覆盖眼睛前部及后部的主要疾病,其中有四款处于临床阶段的候选药物(即CBT-001、CBT-009、CBT-006和CBT-004)及三款处于临床前阶段的候选药物(即CBT-007、CBT-145和CBT-011)。
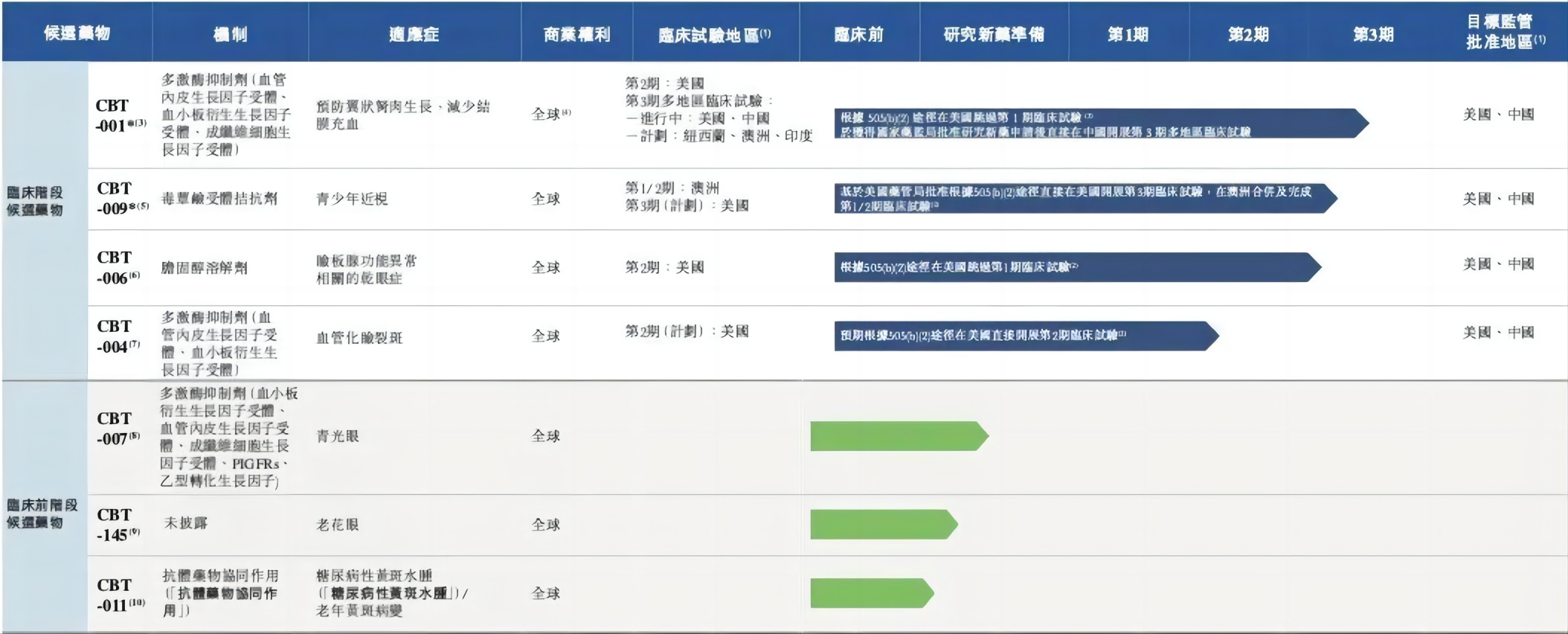
CBT-001、CBT-004分别用于治疗翼状胬肉及血管化睑裂斑,这两类眼科疾病均患者群体庞大,且缺乏针对性而可获得的药物治疗,根据弗若斯特沙利文报告,预计到2032年,全球翼状胬肉及血管化睑裂斑患者人数将分别达至10.771亿人及12.838亿人。
目前,CBT-001已经获得国家药品监督管理局的批准,进入第三阶段多中心临床试验(MRCT),该研究在今年年底开始,CBT-004则已于2023年9月在美国递交临床II期申请。未来这两款药物一旦获批准,将分别是治疗翼状胬肉及血管化睑裂斑的全球同类首创药物。
另外两款产品,CBT-006预期是治疗睑板腺功能异常相关的干眼症(睑板腺功能异常相关的干眼症)的全球同类首创药物,CBT-009预期是治疗青少年近视的全球同类最佳药物。其中,作为拨康视云的核心产品之一,CBT-009滴眼液已于2023年9月21日获得美国药监局的许可,将在美国率先进行临床III期的研究。
除了上述4款临床阶段产品,3款临床前阶段候选药物也颇具市场潜力:CBT-007用于提高青光眼滤过手术的成功率,CBT-145是一种适用于治疗老花眼的新化学实体,CBT-011则是一种适用于治疗糖尿病性黄斑水肿的抗体药物协同作用共轭物。
产品之外,拨康视云亦拥有进行持续开发的能力,公司已开发两个专有技术平台,即MKI及ADS平台:MKI平台能够有效识别、验证及开发新型多激酶抑制剂候选药物,靶向各种眼睛前部疾病,CBT-001、CBT-004、CBT-007三款药物正是基于此平台;ADS平台能够开发通过专有连接头将抗体与小分子药物结合在一起形成的药物实体,用于治疗眼睛后部疾病。