2023年已经过去大半,这几个月来国内新药开发进展迅速。
据Insight 数据库显示,单上半年,共有 75 款新药(含改良新)新进入 III 期(含 II/III 期)临床阶段,包括 43 款化药和 32 款生物药。
作为新药临床研究阶段的关键性试验,III期临床试验是新药能否最终获批上市的临床基础,也是新药开发中成本投入最大、进度比较受外界关注的一个环节。
鉴于以上,我们也专门对倚锋旗下所投项目中提交NDA及获批III期临床的药品逐一统计整理,共涉及16款药物,涵盖多个适应症,遍及肿瘤、感染性疾病、内分泌和代谢性疾病等领域。
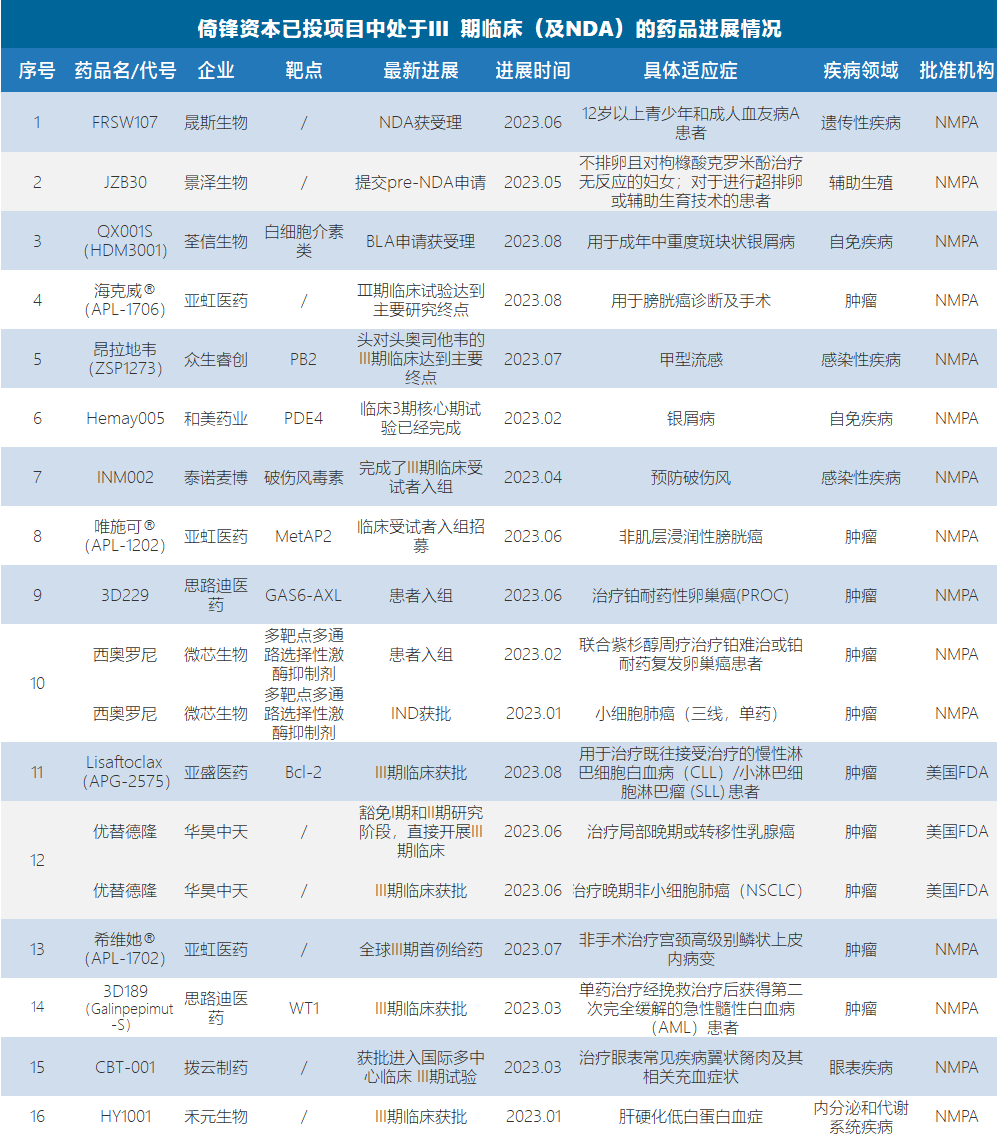
其中,包括晟斯生物注射用重组人凝血因子Ⅷ-Fc融合蛋白FRSW107、荃信生物乌司奴单抗生物类似药QX001S/HDM3001,景泽生物注射用重组人促卵泡激素JZB30等正在提交上市申请。
整体来看,以上所列产品中不乏全球首创或国内首创药物,而这些最新进度不仅预示着企业发展过程中的重大里程碑,更在某些程度上彰显了国产创新药发展的新高度。
以下为所涉及16款药物的详细盘点:
1.FRSW107-晟斯生物
NMPA官网显示,晟斯生物注射用重组人凝血因子Ⅷ-Fc融合蛋白(FRSW107)已于今年6月再次向NMPA提交的上市申请获受理,用于12岁以上青少年与成年人先天性八因子缺乏的血友病A患者的出血控制,也可满足1周2次给药频率的预防治疗需求。
该产品用独创的刚性linker技术,首次获得了有凝血活性的“同源二聚”结构的双头八因子-Fc融合蛋白,在延长八因子半衰期的同时,大大提高了产品的稳定性和产能。产品核心专利已在中国、美国、日本等多国获得授权,形成了极高的技术壁垒。这是首款国产长效重组凝血八因子产品1类新药,有望在2024年上半年获批上市。
此外,2023年下半年,FRSW107即将启动12岁以下儿童血友病A患者中的III期临床试验,有望在2024年底,提交12岁以下儿童用药NDA。
2.JZB30-景泽生物
JZB30是景泽生物管线中进展最快的产品,这是为重组人促卵泡素,用于试管婴儿的促排卵治疗,此前已完成三期临床试验,正在申报生产。
3.QX001S-荃信生物
QX001S/HDM3001注射液是强生公司Stelara®(喜达诺®,乌司奴单抗注射液)的生物类似药,其作用机理为阻断IL-12和IL-23共有的p40亚基与靶细胞表面的IL-12Rβ1受体蛋白的结合,从而抑制IL-12和IL-23介导的信号传导和细胞因子级联反应。IL-12和IL-23是两种天然存在的细胞因子,在免疫介导的炎症性疾病中发挥着关键作用。
QX001S/HDM3001注射液于2018年获得临床批件,2020年完成Ⅰ期临床试验,于2023年6月30日完成Ⅲ期临床研究工作。2020年8月,荃信生物与中美华东就QX001S/HDM3001在中国大陆境内达成合作开发和商业化协议,中美华东为该产品国内上市许可持有人(MAH)。
截至目前,除原研公司外,国内尚无申报上市的厂家。在乌司奴单抗注射液生物类似药中,QX001S/HDM3001的开发进度处于领先位置,有望成为国内首个获批上市的乌司奴单抗注射液生物类似药。
4.海克威®——亚虹医药
8月7日,亚虹医药宣布,其用于膀胱癌诊断及手术的药物海克威®Ⅲ期临床试验达到主要研究终点。公司将于近期向中国国家药品监督管理局(NMPA)沟通新药上市申请(NDA)。
该研究是一项比较APL-1706联合蓝光膀胱镜和白光膀胱镜对膀胱癌检出率的前瞻性、受试者自身对照的多中心III期临床研究。主要终点指标为与白光膀胱镜相比,海克威®联合蓝光膀胱镜额外检出一个或多个膀胱癌病灶(Ta、T1和CIS期)的受试者比例。该研究由中国医学科学院北京协和医院李汉忠教授担任主要研究者。本研究共计入组158例患者,已完成的统计分析结果显示,本研究已顺利完成,并且达到主要研究终点。有关该项临床试验的详细数据,后续将在相关学术会议或期刊上公布。
5.昂拉地韦-众生睿创
7月2日,众生睿创宣布,小分子RNA聚合酶PB2蛋白抑制剂昂拉地韦片(ZSP1273)治疗成人单纯性甲型流感的3期临床试验近日完成顶线数据分析,获得积极结果。研究表明,昂拉地韦较安慰剂可显著缩短中位七项流感症状缓解时间和中位发热缓解时间,较安慰剂或对照药可更好更快地降低甲型流感病毒载量,显著缩短病毒转阴时间。
昂拉地韦片是一款小分子RNA聚合酶PB2蛋白抑制剂,临床上拟用于成人单纯性甲型流感的治疗。该产品通过作为“帽子”结构的类似物与PB2亚基结合,进而抑制RNA聚合酶复合物的复制功能正常启动,从而抑制病毒生命周期基因组的转录和复制等多种功能,达到抗甲型流感病毒的作用。
6.Hemay005-和美药业
Hemay005是赣州和美药业开发的小分子选择性PDE4抑制剂。PDE抑制剂是一类作用于靶细胞中特定PDE的药物,可通过升高细胞内cAMP和/或cGMP水平激活蛋白激酶A/G,促进下游效应蛋白磷酸化,在不同炎症相关疾病中疗效显著。
7.INM002-泰诺麦博
公开报道显示,泰诺麦博核心产品TNM002注射液(抗破伤风毒素单抗)已经完成了III期临床受试者入组即将递交NDA。这是泰诺麦博利用HitmAb®技术平台开发的重组抗破伤风毒素天然全人源单克隆抗体药物,临床前研究结果显示该抗体药物特异性强、安全性好,且具有极高的中和破伤风毒素的能力。
作为天然全人源抗体,TNM002可以最大限度地降低抗体药物的免疫原性,保证了用药的安全性;作为基因重组药物,TNM002可以利用哺乳动物细胞培养进行现代工业化标准的大规模生产,相对于免疫球蛋白,其质量更可控且生产成本更低。预计该抗体药物上市后将逐步取代临床上应用的“马破”和“人破”,为患者带来更大临床受益。
8.唯施可®-亚虹医药
APL-1202单药治疗未经治疗的中危NMIBC III期临床试验在积极推进该临床受试者的入组招募。APL-1202联合替雷利珠单抗用于MIBC术前新辅助治疗的国际I/II期临床试验,已顺利进入到II期研究,并完成II期首例受试者入组,公司正在积极推进受试者的入组招募工作。
全球范围内尚未有任何治疗非肌层浸润性膀胱癌(NMIBC)的口服药物上市,且近年来除了默沙东的Keytruda(帕博利珠单抗)于2020年1月获得FDA有条件批准用于治疗BCG无反应、高危性、伴有或不伴有乳头状肿瘤的原位癌(CIS)的非肌层浸润性膀胱癌(NMIBC)、且不适合或不接受膀胱切除术的患者,NMIBC治疗领域尚无其它新药获批上市。
9.3D229-思路迪医药
试验用药3D-229注射液是思路迪医药从Aravive公司引进的一款“first-in-class”GAS6-AXL抑制剂。在临床前模型中已证实,3D-229注射液可以通过结合GAS6来中和其活性,从而对GAS6-AXL信号传导通路进行选择性抑制。
目前其已在铂耐药性复发性卵巢癌适应症上获得美国食品药品监督管理局(FDA)授予的快速通道资格,并且在多国同期开展临床试验。对已有安全数据的分析表明,3D-229注射液总体上具有良好的耐受性,未见剂量限制性毒性或预计之外的安全信号。
10.西奥罗尼-微芯生物
西奥罗尼是微芯生物自主设计和开发的具有全球专利保护的新化学结构体,属于多靶点多通路选择性激酶抑制剂。西奥罗尼可选择性抑制Aurora B、CSF1R和VEGFR/PDGFR/c-Kit等多个激酶靶点,从而抑制肿瘤细胞增殖、增强抗肿瘤免疫以及抑制肿瘤血管生成,实现多通路机制的抗肿瘤药效,具有相对同类机制药物更优异的动物药效活性和良好的安全性。
其通过抑制小细胞肺癌潜在异常活跃的Aurora B通路相关分子机制,存在单药治疗SCLC疗效的作用基础,这也是西奥罗尼区别于其他抗血管生成治疗药物的重要标志。西奥罗尼在前期的临床试验中,针对多线治疗失败的SCLC患者,相比于历史对照数据,其单药治疗取得了十分积极的疗效结果。
作为治疗严重威胁生命健康的重大疾病、与现有治疗手段相比具明显临床优势的原创新药,去年12月25日,西奥罗尼针对小细胞肺癌适应症被CDE纳入“突破性治疗品种”。
11.APG-2575-亚盛医药
8月7日,亚盛医药宣布,FDA同意其核心品种Bcl-2抑制剂lisaftoclax(APG-2575)开展一项全球关键注册性III期临床试验,用于治疗既往接受治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤 (SLL) 患者。
值得关注的是,APG-2575具全球Best-in-class潜力,是第一个赴美开展全球注册性III期临床的国产Bcl-2抑制剂,同时也是第一个进入III期阶段的国产Bcl-2抑制剂。
12.优替德隆-华昊中天
今年6月,华昊中天官宣了核心品种——优替德隆注射液的最新情况:优替德隆注射液在海外针对乳腺癌和肺癌的两大关键临床研究均已获得美国FDA批准。
其中,值得一提的是,由于通过此前pre-IND会议的充分沟通,FDA认可优替德隆治疗晚期乳腺癌的疗效和安全性,同意豁免I期和II期研究阶段,直接开展III期临床——这在过往也是不多见的。
13.希维她® -亚虹医药
APL-1702的国际多中心Ⅲ期临床试验已获得中国、匈牙利、乌克兰、德国、斯洛伐克、捷克、荷兰、波兰等国家药监机构的批准并在这些国家入组患者,于2022年7月完成所有受试者入组,公司在密切跟进该项临床的随访工作。
在全球范围内尚无针对宫颈高级别鳞状上皮内病变(HSIL)的非手术治疗产品获批上市。APL-1702有望给患者提供全新的治疗选择,让部分患者免除手术治疗的痛苦和副作用,特别是消除手术治疗对育龄妇女患者未来生育功能的影响
14.3D189-思路迪医药
今年3月,思路迪医药(3D Medicines)宣布,其在研候选药物3D189(galinpepimut-S,GPS)单药治疗经挽救治疗后获得第二次完全缓解的急性髓性白血病(AML)患者的Ⅲ期全球多中心临床试验(MRCT)已获国家药品监督管理局(NMPA)的临床试验许可,这也是国内首个进入3期临床的多肽疫苗。
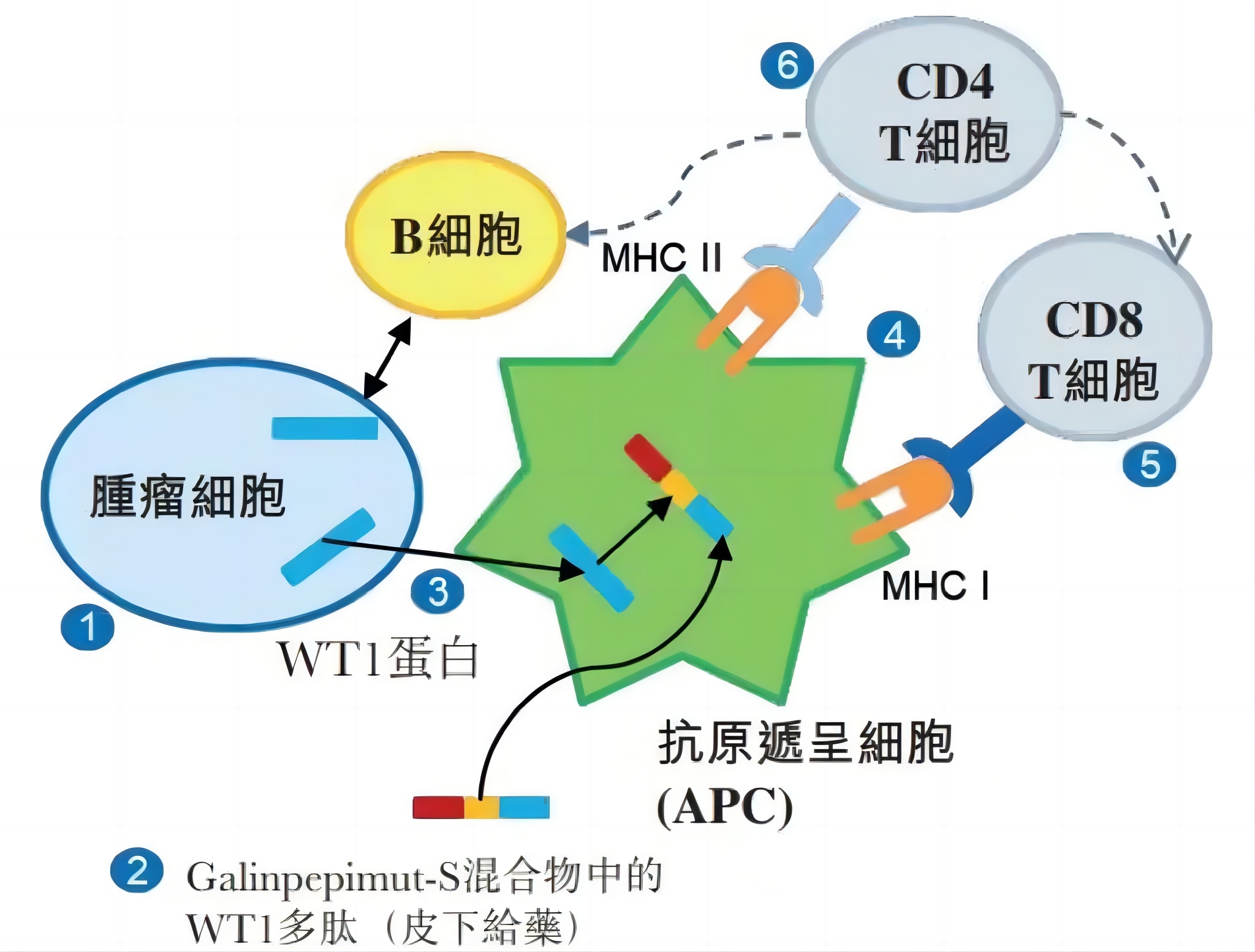
思路迪医药3D189作用原理
此前,3D189在国外已有多项的Ⅰ、Ⅱ期临床研究完成,该MRCT研究(SLG18-301)正在美国和欧洲开展。这是一项开放性、多中心、随机、平行对照研究,预计将招募约116名患者,在全球约110个研究中心进行。
15.CBT-001-拨云制药
今年3月,拨云制药宣布,用于治疗翼状胬肉新药CBT-001近日在中国获批进入国际多中心临床 III期试验。CBT-001是国际首款新药来治疗眼表常见疾病翼状胬肉及其相关充血症状。
公司希望在疾病早,中期介入治疗,以消除翼状胬肉引发的持续眼部红肿,抑制甚至消退翼状胬肉的生长。同时,对于较严重的患者,配合翼状胬肉手术治疗以降低术后复发率。若获批,CBT-001将重新建立治疗翼状胬肉疾病的全球金标准。
CBT-001在2022年已在美国正式启动翼状胬肉与相关充血症状的III期临床试验(CBT-CS301)。随着临床III期试验在中国获批,该药品将展开CBT-001在中国部分的全球多中心临床III期试验。研究方案包括受试者对比滴入CBT-001或者安慰剂,以评估CBT-001滴眼液的长期安全性及有效性(国家药品监督管理局受理号:JXHL2200327通知书编号:2023LP00296)。
16.HY1001-禾元生物
禾元生物植物源重组人血清白蛋白(HY1001)国内Ⅲ期临床已启动——这是公司产品管线中临床进展最快的一款产品,同时也是国际上唯一获得美国FDA批准、国内唯一同时获得中国NMPA和美国FDA批准进入临床研究阶段的重组人血清白蛋白药品。
据了解,由于目前临床使用的人血白蛋白药物均来自人类血浆的分离提取,存在资源短缺和病原体的传播风险。因此自上世纪80年代以来,国际上就一直试图采用基因工程技术生产重组人血白蛋白,但在技术上始终没有突破。截至目前,全球也尚无重组人血清白蛋白药品上市,其他上市产品仅为药用辅料级。
而禾元生物上述产品是利用水稻胚乳细胞表达,经提取、纯化的重组人血清白蛋白产品,在国内III期临床试验中,试验组使用植物源重组人血清白蛋白注射液,将与对照组(即使用人血白蛋白的患者)进行头对头的比较。