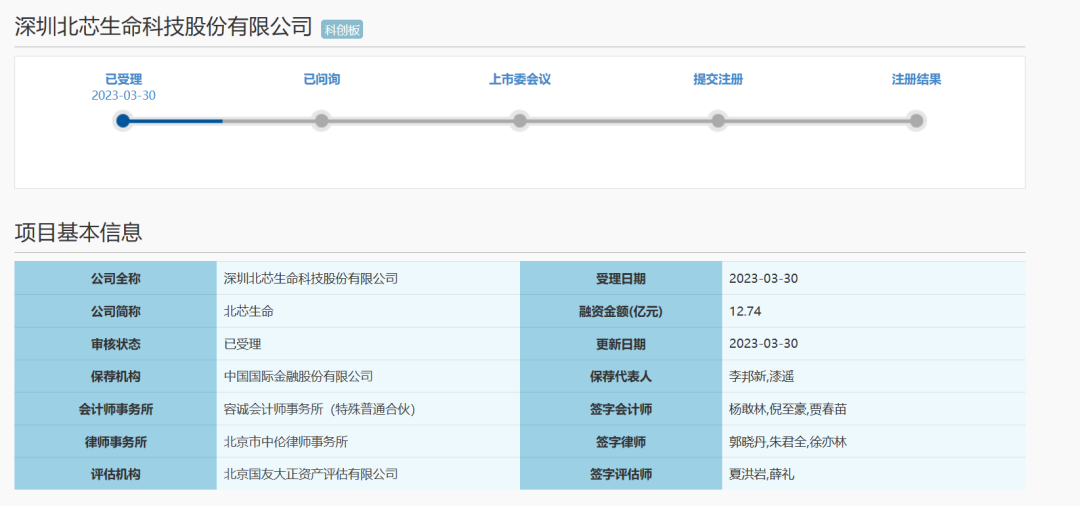
2023年3月30日,根据上交所官网,深圳北芯生命科技股份有限公司(以下简称“北芯生命”)科创板上市申请已获得受理,中国国际金融股份有限公司为其保荐机构,拟募集资金12.74亿元。
图片来源:证监会官网
2020年,倚锋资本参加北芯生命近2亿元B+轮融资。
北芯生命是一家专注于心血管疾病精准诊疗创新医疗器械研发、生产和销售的国家高新技术企业,致力于开发为心血管疾病诊疗带来变革的精准解决方案。
北芯生命此次IPO,符合并适用《科创板上市规则》第2.1.2条第一款第(五)项上市标准:预计市值不低于人民币40亿元,主要业务或产品需经国家有关部门批准,市场空间大,目前已取得阶段性成果。医药行业企业需至少有一项核心产品获准开展二期临床试验,其他符合科创板定位的企业需具备明显的技术优势并满足相应条件。此外,北芯生命作为医疗器械企业,亦符合《上海证券交易所科创板发行上市审核规则适用指引第7号——医疗器械企业适用第五套上市标准》的具体要求。
其中包括中国首个且唯一获国家药监局批准的国产血流储备分数(FFR)测量系统;中国首个进入临床试验并完成患者入组的国产IVUS成像系统,以及具有全球领先性能的微导管产品组合等。
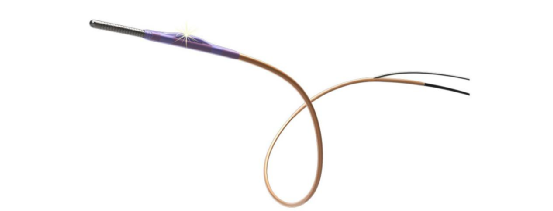
FFR测量系统
公司首款产品,即FFR测量系统是国内首个直接测量FFR的中国产品,该产品由TruePhysio®压力微导管和VivoCardio®血流储备分数测量设备两部分组成。其中TruePhysio®压力微导管是国际第一个基于MEMS传感器的快速交换FFR压力微导管,具有读数稳定准确、极细管身、显著漂移率低、快速交换式设计等国际领先的性能特点和优势。

于2020年获得了Ⅲ类医疗器械的欧盟CE认证,是国际首款中国自主研发生产的直接测量FFR的产品,2020年9月取得国家药监局的III类医疗器械注册证书。自上市以来已覆盖国内30个省市的医院并于2021年占据了 30.6%的国内市场份额, 并在比利时、德国、意大利等海外十余个国家和全球超过 640 家医院实现了临床应用。
于2020年获得了Ⅲ类医疗器械的欧盟CE认证,是国际首款中国自主研发生产的直接测量FFR的产品,2020年9月取得国家药监局的III类医疗器械注册证书。自上市以来已覆盖国内30个省市的医院并于2021年占据了 30.6%的国内市场份额, 并在比利时、德国、意大利等海外十余个国家和全球超过 640 家医院实现了临床应用。

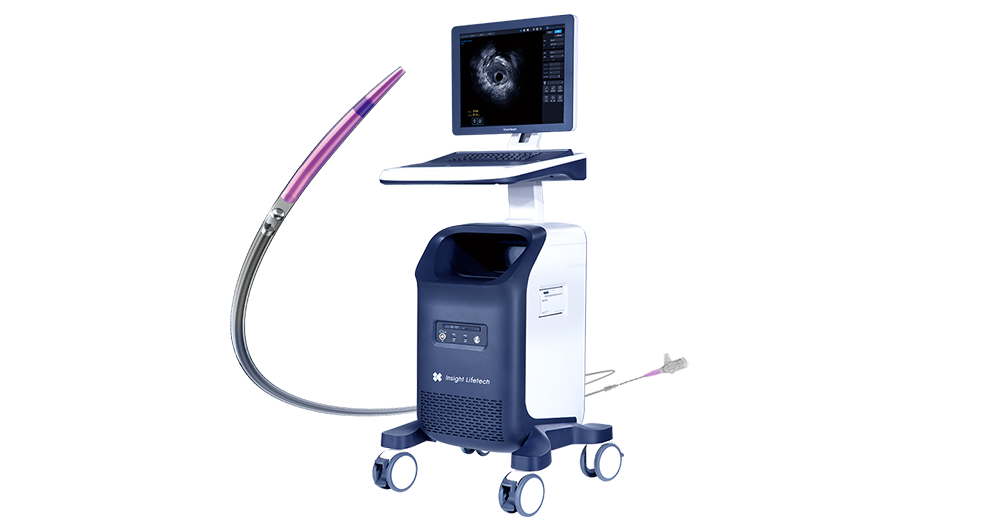
血管内超声(IVUS)
2022年7月,北芯生命“血管内超声诊断仪”和“一次性使用血管内超声诊断导管”2个创新产品注册申请。据悉,其自主研发的血管内超声(IVUS)系统具有行业顶尖的成像分辨率(60MHz超声成像频率)、全球领先的成像速度(100帧/秒断面成像;10mm/s回撤速度)及inSmartVision高性能图像分析平台和优秀的导管操控性能,能够快速、高效地提供血管腔内全貌图像和丰富的病变信息,指导冠脉精准介入治疗的实施,是中国首个自主创新60MHz高速IVUS产品。